TRATAMENTO CONTRA ALZHEIMER
Postado em 08/07/2021 20:52 - Edição: Marcos Sefrin
Agência americana altera indicação; entenda o que muda
Demências como o Alzheimer já atingem 45 milhões de pessoas no mundo e não há tratamentos que atuem diretamente na doença

CRÉDITO,GETTY IMAGES - Legenda da foto,
Após 18 anos sem avanços na área de tratamentos, a doença de Alzheimer finalmente teve um novo remédio aprovado pelo Food and Drug Administration (FDA), a agência regulatória dos Estados Unidos.
O aducanumabe, desenvolvido pelas farmacêuticas Biogen e Eisai, foi liberado em terras americanas no início de junho de 2021, mas uma nova decisão divulgada na quinta-feira (08/07) indica que o número de pessoas que poderá se beneficiar dessa terapia será bastante reduzido.
Inicialmente, o FDA havia sinalizado que o medicamento poderia ser usado para qualquer pessoa que tivesse o diagnóstico desse tipo de demência.
Mas uma mudança na bula feita em julho reduz significativamente o público-alvo dessa nova opção terapêutica: a agência americana agora determina que o aducanumabe está indicado apenas para os pacientes com os sintomas mais leves, que afetam a memória e a capacidade de raciocínio.
Segundo um levantamento feito pelo The New York Times, em termos numéricos, o público-alvo em potencial anteriormente era de 6 milhões de americanos. Agora, fica em cerca de 2 milhões.
O FDA alega que, desde a aprovação em junho, seguradoras de saúde e os próprios cidadãos tinham muitas dúvidas sobre quem deveria pagar pelo tratamento e quando ele seria realmente válido. A alteração serviu justamente para esclarecer essas questões, apontam os representantes.
O aducanumabe tem como alvo a beta-amiloide, uma proteína que forma aglomerados anormais no cérebro de pessoas com Alzheimer. Essas formações podem danificar as células e desencadear demência, incluindo problemas de memória e comunicação, além de confusão mental.
Marasmo total
O aducanumabe estava cercado de grande expectativa — afinal, a última aprovação de um tratamento contra o Alzheimer aconteceu em 2003, há 17 anos, quando um fármaco chamado memantina chegou ao mercado.
De lá para cá, mais de 240 moléculas diferentes foram testadas, mas nenhuma se mostrou segura e eficaz. A taxa de fracasso supera os 99% e é a maior de todas as especialidades médicas — a título de comparação, na área da oncologia, cerca de 80% das terapias falham durante os testes clínicos.
Para completar o cenário, estima-se que 45 milhões de pessoas tenham algum tipo de demência no mundo (2 milhões delas no Brasil). Com o envelhecimento da população em vários países, esse número deve duplicar a cada 20 anos.
Os tratamentos atuais ajudam a controlar alguns sintomas e até atrasam um pouco a progressão da doença, mas eles se tornam ineficazes nos casos mais graves e avançados.
Mas, afinal, por que é tão difícil criar novos tratamentos contra o Alzheimer?
Há uma série de obstáculos e entraves nessa história. E o próprio aducanumabe é um exemplo para ilustrar essa busca infrutífera dos últimos anos.
Esperanças e frustrações
Em meados de 2015, o aducanumabe apareceu como uma das grandes promessas contra o Alzheimer. Os estudos de fase 1 chamaram tanta atenção que foram destaque de capa da revista Nature em 2016.
A droga, desenvolvida a partir de células de defesa de idosos que não tinham demência, se mostrou capaz de eliminar uma proteína chamada beta-amiloide no cérebro.
Pelo que se sabe até o momento, essa substância está relacionada de alguma maneira ao início da doença. Com o tempo, ela se acumula do lado de fora dos neurônios e dá início ao processo de perda das memórias e da cognição.
O aducanumabe foi apenas um entre mais de uma dezena de anticorpos monoclonais feitos para frear esse tipo de demência. Nos testes iniciais, vários deles se mostravam capazes de retirar o excesso dessa tal de beta-amiloide da massa cinzenta.
Porém, quando os estudos progrediam para as fases finais, essa "faxina" cerebral não repercutia nos sintomas da doença: os pacientes continuavam a ter prejuízos nas recordações e na capacidade de raciocinar.
Os cientistas suspeitaram, então, que o problema não estava no mecanismo das drogas em si, mas no momento em que elas eram aplicadas.
Talvez os voluntários recrutados para os estudos estivessem numa fase muito adiantada da doença, em que os danos aos neurônios já eram irreversíveis.
Hoje em dia, se sabe que o Alzheimer começa a corroer o cérebro até duas ou três décadas antes de os primeiros sintomas darem as caras. "A beta-amiloide se acumula com grande antecedência aos incômodos de memória", conta o neurologista Fábio Porto, do Instituto de Psiquiatria do Hospital das Clínicas de São Paulo.
Portanto, um indivíduo que começa a ter falhas nas lembranças aos 80 anos pode estar num longo processo degenerativo, que começou lá quando ele tinha apenas 50 ou 60 anos.
Seguindo essa lógica, será que usar os anticorpos monoclonais antecipadamente, nessa fase assintomática, ou quando os primeiríssimos sintomas aparecerem, poderia fazer alguma diferença?
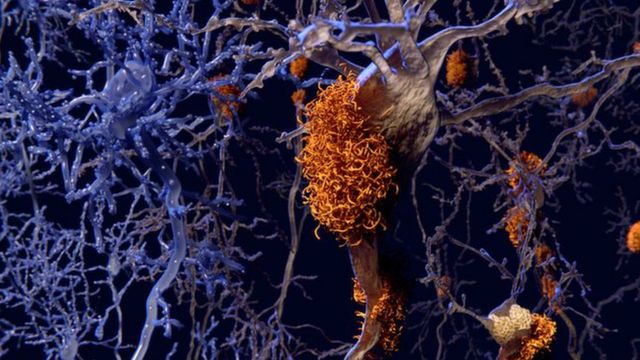
CRÉDITO,GETTY IMAGES - Legenda da foto,
Pelo que se sabe até o momento, a doença se inicia com a deposição da proteína beta-amiloide (representada na cor laranja na ilustração) do lado de fora dos neurônios
Reviravolta surpreendente
Foi justamente para responder a essa pergunta que o aducanumabe foi testado em dois ensaios clínicos de fase 3 (os últimos antes da aprovação) a partir de 2016.
Esses estudos ganharam nomes em inglês: ENGAGE e EMERGE. O primeiro teve a participação de 1.647 voluntários, enquanto o segundo recrutou 1.638 pessoas.
Em março de 2019, os responsáveis pelos trabalhos resolveram fazer uma análise preliminar do progresso até aquele momento, para ver como as coisas estavam evoluindo.
Foi um verdadeiro banho de água fria: os resultados não estavam dentro das expectativas e os estudos foram encerrados antes do prazo.
Sete meses depois, veio a notícia que ninguém esperava: Biogen e Eisai anunciaram que haviam reavaliado as duas pesquisas e encontrado em uma delas evidências de que o aducanumabe poderia, sim, funcionar num determinado grupo de pacientes.
As empresas foram além e disseram que, a partir dos dados, pediriam a liberação do medicamento para uso clínico nos EUA.
E essa trajetória foi concluída em junho de 2021, quando o FDA deu a aprovação, apesar de todas as polêmicas envolvidas nessa história.
As controvérsias
A mudança de rumos, o pedido e a aprovação pegaram a comunidade científica de surpresa. Afinal, não é comum que pesquisas como as que estavam em andamento sejam paralisadas ou reanalisadas no meio do caminho.
A surpresa ficou ainda maior agora, com essa mudança incomum na bula logo em menos de um mês após o ok regulatório.
"Geralmente, todo o desenho do estudo clínico é definido antes do início. Fazer modificações assim é uma coisa muito complexa, que leva a problemas estatísticos", diz o neurocientista Eduardo Zimmer, professor do Departamento de Farmacologia da Universidade Federal do Rio Grande do Sul.
O químico americano Derek Lowe não poupou críticas aos movimentos feitos por Biogen e Eisai. Numa série de textos publicados em seu blog In The Pipeline, no site da revista Science, no final de 2020 ele demonstrou desconfiança com os resultados do aducanumabe:
"Eu não acredito que as empresas demonstraram a eficácia [do medicamento]. Eu acho que eles têm capacidade suficiente para fazer um estudo melhor se assim quisessem. Mas eles não querem. Eles desejam ir logo até o FDA para ter a droga aprovada e começarem a imprimir dinheiro".
Os especialistas dizem que, antes de buscar a aprovação nas agências regulatórias, os responsáveis pelo fármaco deveriam fazer um novo estudo de fase 3, que focasse justamente nessas doses mais altas e nesse perfil de pacientes que parece se beneficiar mais do remédio.
O problema é o tempo. "Esses novos testes exigiriam um investimento econômico gigantesco e demorariam mais quatro ou cinco anos para darem os resultados", estima Zimmer, que também é membro da Academia Brasileira de Ciências.
E no Brasil?
Em março, a Biogen anunciou que também pediu a aprovação do aducanumabe para a Agência Nacional de Vigilância Sanitária (Anvisa).
Em uma nota, a empresa disse que "o medicamento teria o potencial de alterar a fisiopatologia da doença, desacelerar o declínio cognitivo e manter a capacidade dos pacientes em realizar certas atividades diárias por um período, incluindo a gestão de finanças pessoais, a realização de tarefas domésticas, como limpeza e atividades relacionadas à lavanderia, compras e viajar independentemente".
Num comunicado para a imprensa, Tatiane Rivas Marante, gerente geral da farmacêutica no Brasil, afirmou que, se aprovado, o aducanumabe poderia "se tornar um vetor de esperança para aqueles impactados por essa doença devastadora".
Até o momento, ainda não houve nenhuma resposta oficial da Anvisa sobre o caso e se a medicação também será liberada em nosso país.

CRÉDITO,GETTY IMAGES - Legenda da foto,
O tratamento atual do Alzheimer envolve a prescrição de medicamentos que aliviam os sintomas nas fases iniciais, mas se tornam inefetivos com a progressão da doença
Mais pedras no caminho
A dificuldade em demonstrar o benefício prático de uma nova molécula é apenas a ponta do iceberg desse drama que aflige milhões de pacientes e seus familiares.
Pesquisadores da área enfrentam uma série de outras barreiras para entender o Alzheimer e seus desdobramentos.
Para começo de conversa, não existe um modelo animal que permita replicar as características do cérebro humano e da doença de Alzheimer com fidelidade.
Isso dificulta bastante na hora de fazer trabalhos experimentais, ou mesmo entender a ação de novas drogas em cobaias. Esse estágio de pesquisa é essencial antes de que as formulações sejam encaminhadas para testes com seres humanos.
Outra barreira importante está no diagnóstico: atualmente, a detecção do Alzheimer depende de testes muito invasivos ou muito caros.
É o caso, por exemplo, da análise do líquor, uma substância encontrada na medula óssea, ou do PET-CT, um exame de imagem bastante específico. "Esses são métodos ainda pouco acessíveis, por razões técnicas e financeiras", pontua Porto.
Na hora de realizar estudos clínicos, por exemplo, os laboratórios gastam milhões de dólares para garantir que os voluntários façam exames do tipo e conferir se eles realmente têm Alzheimer. Esse investimento maciço é algo que poucos laboratórios conseguem fazer.
Por fim, há muitas dúvidas sobre o mecanismo que está envolvido neste tipo de demência. Ainda existe controvérsia sobre o papel da proteína beta-amiloide na doença e como ela interage com várias substâncias que se alteram no cérebro durante o processo de degeneração, como uma outra proteína conhecida como TAU.
Enquanto esses mistérios permanecerem, é difícil desenvolver tratamentos específicos capazes de atuar em alguma etapa da enfermidade.
Promessas futuras
Vale destacar, por fim, que o aducanumabe não é a única opção que chama a atenção de pesquisadores e da comunidade de pacientes e familiares: de acordo com o site ClinicalTrials.Gov, mantido pelo governo americano, outros 2.623 testes clínicos com candidatos a remédios contra o Alzheimer estão em andamento neste exato momento.
Um que é acompanhado de perto é o solanezumabe, da Eli Lilly. Ele também atua na proteína beta-amiloide e está sendo avaliado em pacientes com sintomas bem iniciais da enfermidade. Se tudo der certo, seus resultados são esperados para 2023.
Em paralelo, outros grupos de cientistas procuram caminhos criativos para frear a progressão do Alzheimer. Alguns miram na proteína TAU, que aparece no cérebro nas fases mais avançadas da condição.
Outros vão além e testam terapias à base de luzes ou maneiras de modificar a microbiota intestinal, um conjunto de bactérias que vive no nosso sistema digestivo e parece influenciar até na saúde do cérebro.
Num cenário sem grandes novidades e algumas polêmicas recentes, o alento é que o futuro promete trazer notícias um pouco mais animadoras.
Matéria feita por André Biernath - @andre_biernath - Da BBC News Brasil em São Paulo
Ref.: https://www.bbc.com/portuguese/

Ocorreu um erro de reconhecimento de sua tela. Atualize a página.







